ISO 13485:2016
De norm voor Medical Devices
Wanneer u medische hulpmiddelen op de Europese markt brengt, dienen deze aan de Europese kwaliteitswetgeving en -richtlijnen te voldoen. Het invoeren van een kwaliteitssysteem volgens de EN ISO 13485 en ISO 14971 helpt u hierbij. Deze normen, waarbij risicomanagement een belangrijke rol speelt, zijn specifiek ontwikkelt voor fabrikanten van medische hulpmiddelen. ISO 13485:2016 wordt ook veel gevraagd door fabrikanten van medische hulpmiddelen aan bedrijven die medische hulpmiddelen opslaan, een deel van het productieproces uitvoeren of onderdelen produceren voor een medisch hulpmiddel. Als organisatie bent u dan een kritische subcontractor van de wettelijk fabrikant. ISO 13485 certificering is niet verplicht. Wel stelt de wet de aanwezigheid van een kwaliteitsmanagementsysteem verplicht.
Behalve dat bij certificering deze norm aantoont dat uw processen gecontroleerd en geborgd zijn is het een zeer goede basis voor de Medical Device Regulation welke de Medical Device Directive in 2020 vervangt.
De belangrijkste wijzigingen in de vernieuwde ISO 13485:2016 zijn;
• Definities van onder andere de fabrikant, distributeur en importeur zijn verduidelijkt zodat helderder wordt wie door regelgeving als wettelijke fabrikant wordt beschouwd;
• Risicomanagement en besluitvorming op basis risico’s niet alleen van toepassing op ontwerp en ontwikkeling, maar voor alle onderdelen van het kwaliteitsmanagementsysteem. De term risico is op ongeveer 30 plaatsen toegevoegd aan de normeisen;
• Aanvullende eisen en duidelijkheid ten aanzien van verificatie, validatie en ontwerpactiviteiten; waaronder de toevoeging van overdracht van het ontwerp als ontwerpactiviteit (sectie 7.3.8) en de synergie met de FDA Device Master Record (DMR) aangegeven in sectie 4.2.3.;
• Versterking van de leverancierscontroleprocessen;
• Toegenomen focus met betrekking tot feedback mechanismen;
• Meer expliciete eisen voor software validatie voor verschillende toepassingen
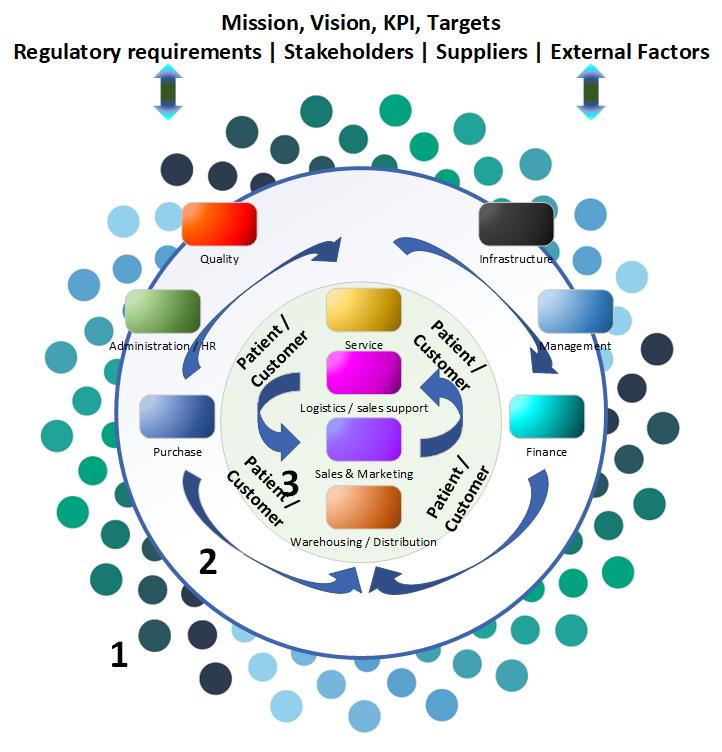
De transitieperiode van ISO 13485:2003 en ISO 13485:2012 is tot 29 februari 2019. QMS Improvement kan u adviseren en begeleiden bij het opzetten van uw QMS systeem conform de norm EN ISO 13485:2016 waarbij wij gebruikmaken van een modulaire toepassing. Afhankelijk van uw organisatie zijn clausules uit de norm toepasbaar of mogen deze, mits goed onderbouwd, uitgesloten worden. In onderstaande afbeelding ziet u een voorbeeld van toepassing van de werking van de modulaire opzet.
" Het systeem is zeer kundig opgezet, de modulaire toepassing maakt dat jullie als groeiende organisatie dit systeem gemakkelijk kunnen uitbreiden"Quote van Lead Auditor Bureau Veritas
Bespaar tijd
Bespaar tijd met het opzetten van uw systeem door gebruik te maken van onze standaard templates, risico-analyse en correctieve en preventieve action sjablonen.
Eenvoudig te bewerken
Door onze modulaire opbouw van uw systeem blijft het makkelijk te onderhouden, ook als u groeit
Vriendelijke ondersteuning
Door met elkaar in contact te blijven weten wij wat in uw organisatie speelt en kunnen wij u blijven ondersteunen
Uw bedrijf laten groeien
Zie hoe uw winst toeneemt en uw waarde stijgt als u de efficiëntie van uw bedrijf stimuleert. Het is eenvoudiger dan u denkt.


